海外ニュース:FDAはペミガチニブをFGFR2融合遺伝子陽性進行胆管がんに承認
Pemigatinib
海外ニュース:FDAはペミガチニブをFGFR2融合遺伝子陽性進行胆管がんに承認
WILMINGTON, Del.--(BUSINESS WIRE)
2020年4 月17 日
Incyte社の発表によると、米食品医薬品局(FDA)は、FGFR2融合遺伝子または遺伝子再構成の発現が認められる胆管がん患者に対し、過去に治療歴のある、または切除不能/局所進行/転移性の胆管がんのセカンドライン治療薬として、キナーゼ阻害剤のペマジルPemazyre™(一般名:Pemigatinib、ペミガチニブ)を承認した。この胆管がんへの適応は、ペミガチニブが初のFDA承認薬となり、全奏効率と奏功期間(DOR)に基づいて迅速承認された。
Pemigatinib
海外ニュース:FDAはペミガチニブをFGFR2融合遺伝子陽性進行胆管がんに承認
WILMINGTON, Del.--(BUSINESS WIRE)
2020年4 月17 日
Incyte社の発表によると、米食品医薬品局(FDA)は、FGFR2融合遺伝子または遺伝子再構成の発現が認められる胆管がん患者に対し、過去に治療歴のある、または切除不能/局所進行/転移性の胆管がんのセカンドライン治療薬として、キナーゼ阻害剤のペマジルPemazyre™(一般名:Pemigatinib、ペミガチニブ)を承認した。この胆管がんへの適応は、ペミガチニブが初のFDA承認薬となり、全奏効率と奏功期間(DOR)に基づいて迅速承認された。
「わが社における胆管がんでのFGFR2融合遺伝子または遺伝子の再構成に関する研究と、初の標的治療薬となるペミガチニブの開発は、科学的研究を人々の生命を支えるソリューションに応用するというわが社の積極的な取り組みを代表するものです。ペミガチニブを患者の皆さまにお届けすることを誇りに思い、この新しい治療薬を使えるように迅速に取り組んで参ります。」と、Incyte社のCEOエルベ・オッペノ氏は語った。
このFDAの承認は、FIGHT-202と呼ばれる成人胆管がん患者を対象とした多施設共同オープンラベル単一アーム試験で行われたペミガチニブの評価を基に実現した。FGFR2融合または再構成を伴う患者(コホートA)にペミガチニブを単剤投与した結果、全奏効率36%(第一評価項目)、DOR中央値9.1ヵ月(第2評価項目)となった。ペミガチニブの注意事項としては、ドライアイや結膜炎、涙液増加、網膜異常などの眼への影響、血中リン酸塩の上昇、また妊娠中の女性では流産や胎児への有害なリスクがある。
FDAは、過去に治療歴のある進行/転移性または切除不能な胆管がんでFGFR2融合遺伝子のある患者の治療薬として、ペミガチニブを「画期的治療法(Breakthrough Therapy)」に指定した。さらに、FDAはペミガチニブを胆管がんのオーファンドラッグ(希少疾病用医薬品)に指定し、FDAの優先評価プログラムにおいてその新薬実用性(NDA)を検討した。
「胆管がんは希少がんとされているが、この30年間増加傾向にある。一次治療としての外科手術や化学療法後の再発率が高く、このような新たな標的治療オプションが加わることは心強い。」とメモリアル・スローン・ケタリング・キャンサーセンターのガッスン・アボウ・アルファ博士は語る。
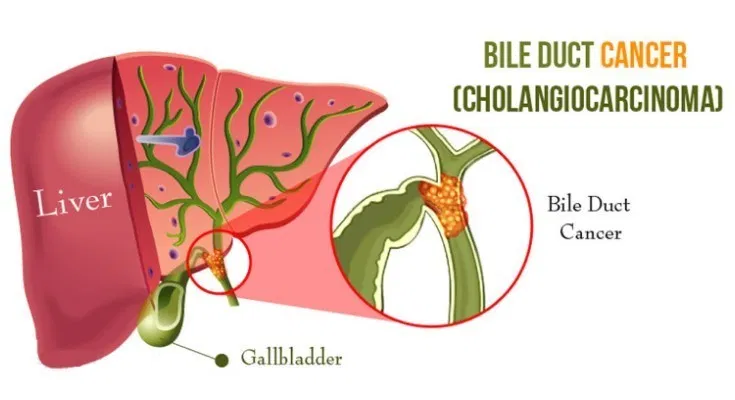
胆管がんは胆管内に形成される希少がんである。解剖学的に、その発生部位により、肝臓内の胆管内に発生する肝内胆管がん(iCCA)と、肝臓外の胆管内に生じる肝外胆管がんに分類される。胆管がんは、発見が難しく進行がんで発見されることが多く、予後は不良である。
患者数は地域差があり、北米及びヨーロッパでは、10万人に0.3~3.4人とされる。FGFR2遺伝子融合または再構成は、肝内胆管がんに特異的で、10~16%に見られる。FGFR2遺伝子はがん細胞増殖と患者の生存期間、血管創生(新規血管の形成)に重要な役割を果たす。FGFR遺伝子の融合、再構成、転座、遺伝子増幅の活性は、様々ながんの発生に深く関与する。
「本日のペミガチニブの承認は、新しい治療オプションを提供するもので、限られた治療法しかない、また、厳しい予後に直面する患者の皆さまに希望をもたらすものです。」と、Cholangiocarcinoma Foundation理事のステイシー・リンゼイは語った。
Incyte社 は患者を支え、治療を受けやすくするように取り組んでいる。ペミガチニブを処方された米国内の患者は、IncyteCARESプログラムを通して財政的支援や教育、情報提供などの患者支援を受けることができる。(詳細は Pemazyre.comを参照.)
さらに、FDAはペミガチニブの付随的診断法として、包括的ゲノム解析検査であり全ての固形がんの診断プラットフームとして日米で承認されているFoundation MedicineのFoundationOne®CDxを承認する見込みである。これが承認されれば、ペミガチニブ適応となるFGFR2遺伝子融合または再構成の患者を同定することが促進されるであろう。なお、FGFR2融合遺伝子を持つ胆管がん患者は、胆管がん患者の約9~14%といわれている。#
Translated by M. Watanabe
=======================================
Source:
https://investor.incyte.com/news-releases/news-release-details/fda-approves-incytes-pemazyretm-pemigatinib-first-targeted
編集注:DOR=Duration of Response 奏功期間
編集注:肝内胆管がん=intrahepatic cholangiocarcinoma:. iCCA